小核酸药物在经历了高开低走后终于再次迎来春天,众多MNC下场收割管线,BD交易额再创新高,其中不乏涌现中国本土企业的身影。国内小核酸药物虽布局已久,但至今仍未有产品获批上市,究其原因是同质化严重,源头创新不足。
本文认为可从以下三方面下大力以谋求突破:
01重视化学修饰与递送载体创新。搭建特有化学修饰平台,创新递送载体尤其是肝外递送或改变已有载体的偶联方式,提高核酸药物的开发效率和差异化定位。
02重视适应症与靶点扩展。不局限于已成药的,成熟的适应症和靶点,可从同一适应症的不同靶点,同一靶点的不同适应症率先做出突破
03重视CMC生产工艺升级。创新核苷单体、序列合成方案,开发独家杂质分析方法,建立生产控制指南以形成技术壁垒
今年年初,舶望制药向诺华授权多项siRNA心血管管线,凭借41.65亿美元交易额霸占历年小核酸BD榜首。苏州瑞博生物也与德国勃林格殷格翰(Bl)就非酒精性脂肪性肝炎(NASH/MASH)共同开发小核酸创新疗法,总金额超过20亿美元。
截至目前,全球小核酸领域已发生236起交易(包括license in、license out以及企业合作),涉及近千亿美元。而这两次重磅对外交易都来自中国本土企业,是全球刚起步的小核酸药物。
就像瑞博生物高级副总经理、CSO高山说的那样:当下本土的小核酸领域已经处在爆发前夕。这并不是偶然事件,是十年磨一剑的战略成功。
2008年当江苏昆山高新区喊出“做核酸,到昆山”的时候,小核酸技术在全球才刚兴起,国内也刚提出“重大新药创制”专项。当初的昆山为何极力促成瑞博落户,在没有产业基础的情况下“甘做冷板凳”,正是瞄准了小核酸药物的未来潜力。
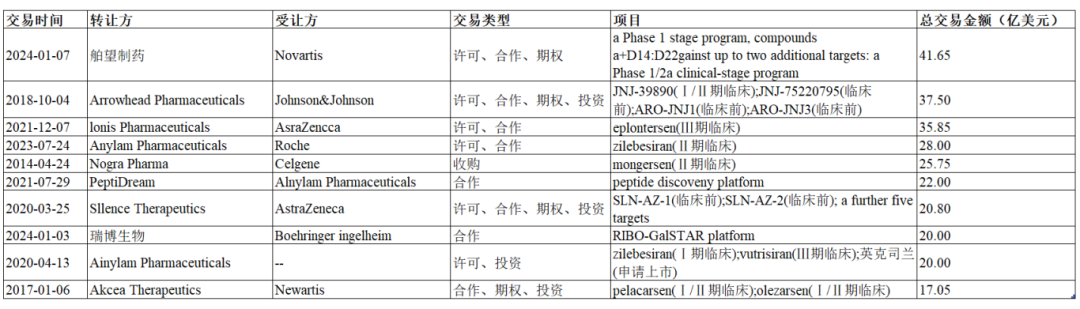
图1历年小核酸BD总交易额TOP10
小核酸药物区别于目前市场主流的小分子、大分子药物,其靶向目标不是致病蛋白而是RNA,即从转录层面调控基因的表达(上调、抑制、沉默)从而实现对疾病的治疗。
依赖于小核酸药物“治本”的特点,理论上可以覆盖绝大部分的已知疾病,并且达到低频次,高药效的治疗效果。另外由于其不需要大规模药物筛选,在研发周期和成功率上也更具优势。根据不同的作用机制,小核酸药物可以分为RNAi药物(siRNA、miRNA等)、ASO药物、核酸适配体和其他类(saRNA、tRNA碎片等)。
据业内预计,2025年全球小核酸药物销售额将突破100亿美元,2030年我国小核酸药物市场也将达到100亿元。截至目前,全国共有近60家企业布局,30余款药物进入临床阶段。
从产品布局看,以siRNA和ASO为主,尤其是siRNA,占比50%。
从研发进度看,近四成的企业还处在临床前研究(包含概念验证、探索性研究等);进入临床阶段的产品中,55%处在临床Ⅰ期(包含海外),32%处于临床Ⅱ期,进度最快的是临床Ⅲ期,分别来自于瑞博生物和维亚臻生物。从适应症看,小核酸药物主要围绕传染性疾病、心血管疾病、肿瘤、代谢疾病、中枢神经性疾病等,在乙肝和心血管疾病领域聚集较多。
从区域分布看,主要在环渤海、长三角、大湾区和成都,其中上海布局的企业最多,苏州、北京、杭州紧随其后。
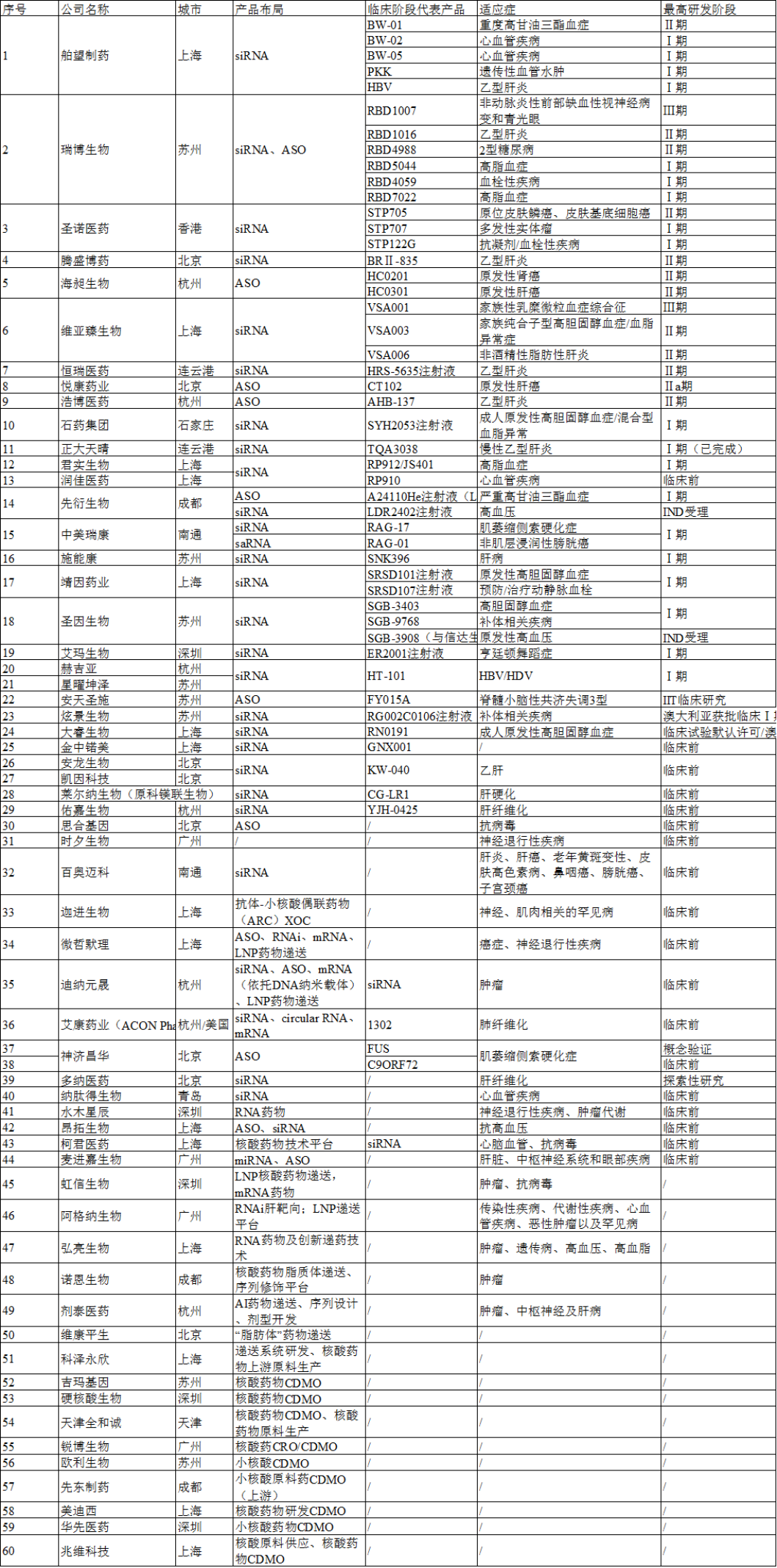 图2国内小核酸企业盘点(据不完全统计)
图2国内小核酸企业盘点(据不完全统计)
就在国内争相加快研发进度,力求获批首个核酸上市的同时;国际上已有19款小核酸药物获批,其中16款上市并销售。诺华从MDCO公司收购的降脂神药Leqvio(Inclisiran)2024上半年销售额高达3.33亿美元(约合人民币24.22亿元),同比增长135%。
面临先发优势的国际环境,临床扎堆的国内环境,中国小核酸是否会像新冠疫苗一样昙花一现,兆维科技创始人/董事长江伟在某次会议中给了我们答案“中国小核酸企业要想在激烈的竞争中生存下来,答案一定是差异化!“
一、化学修饰与递送载体差异化
美迪西化学部田宝泉主任曾提到:核酸药物要进入体内发挥作用,首先要克服降解的问题,其中化学修饰和递送系统技术的突破对核酸药物的发展起到了至关重要的作用。化学修饰即对核酸单体进行修饰,未经修饰的天然核酸往往存在成药性差、稳定性差、特异性低、安全性低等问题。
目前常见的修饰方式大体可分为磷酸骨架修饰、核糖修饰、碱基修饰等。不同位点的修饰,同一位点不同形态的修饰,修饰位点、形态之间的组合等都会产生不同的效果。因此,企业通过搭建特有化学修饰平台,创新修饰方案,将利于核酸药物的开发效率和差异化定位。
施能康联合创始人、CEO兰涛博士曾在采访中表示:施能康新型化学修饰平台开发的siRNA分子,相对于早先的化学修饰技术,其生物活性明显提高,PK有所改善,体内药效持续时间显著延长。
由于核酸药物的负电荷性和亲水性,导致其细胞通透性差,难以跨越细胞膜进入体内发挥作用。因此递送载体是全球核酸药物研发的热点,药企往往通过专利壁垒形成技术垄断。
北京大学药学院化学生物学系教授张力勤曾在采访中表示:递送系统是核酸药物能够成药的关键,一个好的递送技术能带动多个药物诞生。递送载体大体可分为偶联递送系统(GalNAc等)、纳米递送系统(LNP等)和其它递送系统(外泌体、**等)。其中GalNAc和LNP是目前较为成熟的两种递送载体,在目前上市的小核酸药物中,siRNA多数采用GalNAc递送,ASO则多以裸RNA形式直接起作用。但这两种递送载体均对肝脏的靶向效果明显,无法将药物递送到肝外,使得小核酸药物局限于肝病或者肝靶点介导的疾病,适应症狭窄。
因此,企业通过创新递送载体或改变已有载体的偶联方式,尤其是解决肝外递送难题将加快产品从me-too到first-in-class,从而形成差异化优势。
瑞博生物科技董事长梁子才也曾在采访中提到:“肝外递送系统成为整个行业竞速研发的领域,谁能最先突破肿瘤、心血管、中枢神经等系统的递送瓶颈问题,并得到产业验证,谁就能“攻下一城”。
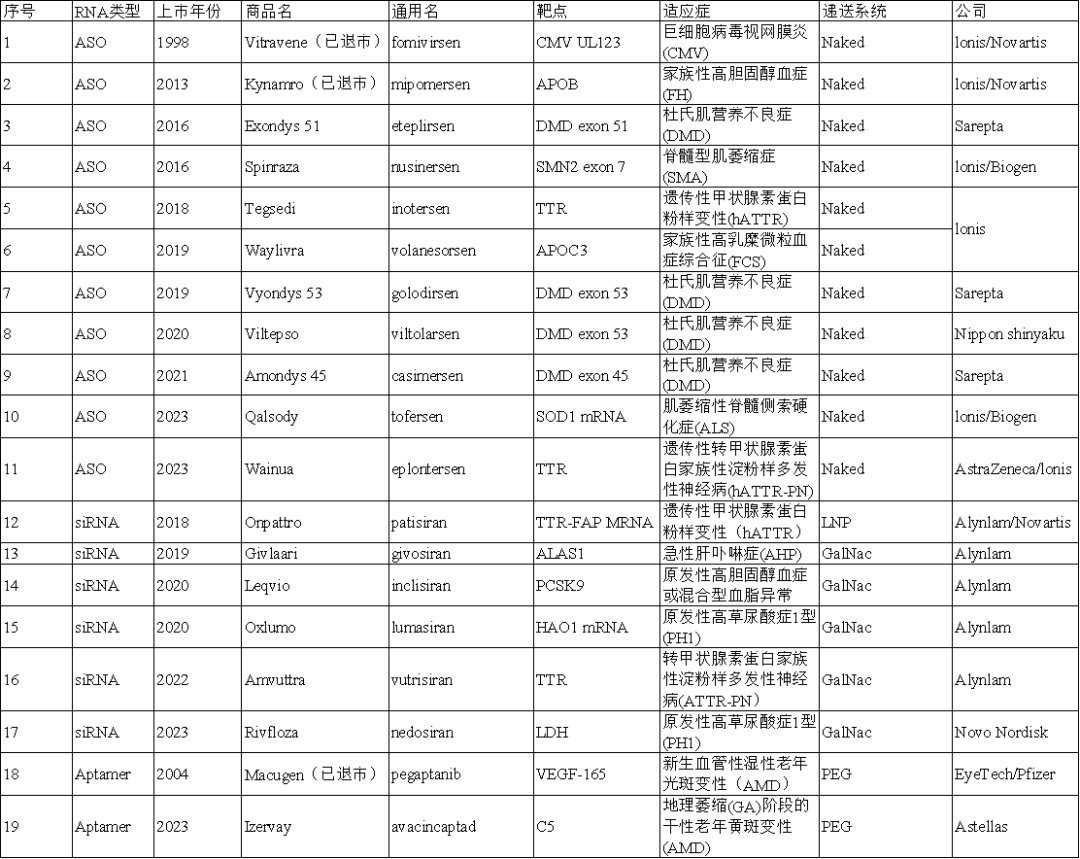
图3全球已上市小核酸药物盘点
二、适应症与靶点差异化
Leqvio(Inclisiran)的上市成功将小核酸药物从罕见病推向常见病,彻底打开了对心血管代谢病的开发。国内也借此直接跳过罕见病,进入了慢性病领域。
然而由于递送载体的限制,导致国内的研发布局形成了两大阵营。一类是基于已成药的,较为成熟的适应症和靶点。例如靶向PCSK9以治疗高血脂(Leqvio)。这一阵营主要由资金实力雄厚的上市企业和拥有较为完备的核酸技术平台(引进/积累)的企业组成。
另一类是基于创新递送载体专注于肿瘤、肌肉疾病等空白领域的中小型企业。第一阵营的扎堆企业较多且产品研发速度较快,基本都已进入临床阶段,第二阵营的企业数量少且大多处于成长期,产品研发速度缓慢且基本处在临床前期。在这种发展模式下,本土企业只能顺应潮流却无法真正引领潮流。
思合基因创始人&CEO王海盛曾在采访中表示:小核酸药物的突围要打开思路,突破只追求“科学性”的框架,药物发现很多时候并不是解决一个单独的科学问题,更多的实际上是在应用层面去满足未满足的临床需求。
因此,国内小核酸企业在研发布局时要基于现实需求,勇于打破常规,可以率先从同一适应症的不同靶点,同一靶点的不同适应症着手,踏出源头创新的第一步。
三、CMC生产工艺差异化
小核酸药物的开发、生产流程与抗体药物类似,需要经过适应症选择、靶点筛选、序列设计及筛选、化学修饰、递送系统、CMC放大生产等过程。
由于小核酸药物的作用体是核酸序列,所以从核苷单体的合成到序列的合成再到质量控制是CMC生产的关键。合成方法目前有固相合成、液相合成两种,两者对生产设备及环境要求极高,若想获得比较大的生产量,成本也将成为制约因素。
另外,贝信生物CEO孔素东博士曾在会议中提到:由于它们容易被酶类降解,在放大时如何减少药物降解也是一个挑战。所以,在合成方案(单体的化学修饰)、工艺参数、甚至试剂和设备的配套上形成技术壁垒将有效建立竞争优势。
另外,由于小核酸药物市场整体还处在早期,在质量控制上还没有明确的法规可供指导尤其是杂质限度,因此开发独家杂质分析方法,建立生产控制指南将有效提高自身产品质量,同时有利于在国际上获得更高的话语权。
业内有一个观点:核酸药物是继小分子、生物大分子之后第三个结构性的机会,将引领第三次药物浪潮。暨南大学基础医学院生化系费嘉教授却在一次会议中指出:不能简单地认为第三代药物必然优于第一代或第二代,药物的疗效和数据才是判断的准绳。
的确,回顾FDA批准的药品仍是小分子药居多。小核酸药物虽风口已至,却是“小荷才露尖尖角”,在安全性、稳定性等方面有很大改善空间,在肝外递送、非编码RNA等领域也有很大的空白区。适应症方面,中美瑞康首席战略官谢文凯曾表示,“国内患者群体基数较大,未来有一定的发展空间。”
挑战与机遇并存,国际上虽已率先出击,国内也在迎头赶上,早日通过原始创新形成差异化优势,才能在这场新战役中搏一杯羹。
来源|诗迈医药研究院
