2020年新冠疫情爆发,mRNA疗法首次进入人们视野,辉瑞/BioNTech联合开发的BNT162b2(Comirnaty)以及Moderna的mRNA-1273(Spikevax)先后在美国获得紧急使用授权。之后这两款产品分别于2021年与2022年获批上市,成为了当时全球唯二上市的mRNA药物。
然而早在二十世纪九十年代,研究者们就已成功使用体外转录(IVT)mRNA在动物中产生蛋白质,之后致力于将此技术拓展到临床应用。虽然之后WHO宣布COVID-19不再构成国际关注的突发公共卫生事件,但这次疫情加快了mRNA技术平台、产业链的形成,彻底打开了mRNA药物研发的新局面。
本文将简单介绍mRNA疗法的种类、原理和特点,发展现状、技术要点和未来发展方向。
一、mRNA疗法的分类、原理和作用特点
信使RNA(mRNA)是一种单链长核糖核酸,能够传递DNA中的遗传信息并经过翻译合成蛋白质。mRNA疗法则是一种利用mRNA来指导人体细胞产生特定蛋白质的医疗技术。即基于靶点或抗原设计合成特定的mRNA序列,通过特定的递送系统进入特定的细胞质内并产生特定的蛋白质,在细胞内或分泌到细胞外后,刺激免疫系统并产生免疫反应以达到治疗或者预防疾病的治疗手段。
所以理论上mRNA可以翻译成任何蛋白,以蛋白为治疗手段的药物均可以被mRNA疗法替代。根据所编码的蛋白类型,mRNA药物可以分为两大类:
一类是编码抗原蛋白,即mRNA疫苗。根据疫苗的接种目的可进一步分为预防性疫苗和治疗性疫苗,也可根据疾病类型分为感染性疾病的疫苗和肿瘤疫苗。
另一类是编码非抗原蛋白,即mRNA治疗药物。根据蛋白的种类,又可细分为编码抗体、酶、细胞因子、生长因子,甚至编码基因编辑蛋白发挥基因编辑作用,基于mRNA的细胞疗法等。
编码抗原序列的mRNA疫苗通过脂质纳米载体等递送平台被引入细胞,然后由人体细胞通过翻译产生抗原,激活免疫反应。与传统疫苗相比,mRNA疫苗通过内源性表达抗原蛋白,避免了体外因素影响的同时可以诱导更为广泛有效的细胞免疫及体液免疫反应,并消除包括癌细胞在内的自体威胁,保护率更高。
另外,mRNA疫苗与某些**疫苗不同,mRNA不会整合到基因组中,从而避免了对插入突变的担忧,安全性更高。此外,单个mRNA疫苗可以编码多种抗原,增强针对适应性病原体的免疫反应,并能够以单一配方针对多种微生物或**变体,功能性更强。
治疗性药物通过体外合成mRNA序列,再由不同递送系统结合不同注射方式递送到细胞内,从而实现在病人自体细胞中启动药物的生产,补偿有缺陷的基因/蛋白质。
mRNA平台可以转化成各种蛋白质药物形式,如单克隆抗体、酶和细胞因子等,与重组蛋白或小分子药相比,mRNA治疗性药物的开发和制造相对简单,成本效益更高。
此外,可以轻松修改mRNA序列,从而实现mRNA治疗的个性化。在基因编辑领域,可通过注射mRNA以实现细胞质中编码如Cas9等核酸酶,相较于质粒DNA介导等方式,其表达迅速且没有基因整合风险。在细胞治疗领域,可通过载体将编码可识别并攻击癌细胞遗传信息的mRNA靶向递送到免疫细胞中,实现体内如CAR-T细胞的快速制备。
这种基于mRNA的细胞疗法省去了从患者体内分离细胞、在体外进行工程化改造的繁琐过程。另外,传统细胞疗法的使用过程中还需要化疗,并有可能带来一系列的副作用。而体内生成的细胞疗法则无需这一步骤。
二、mRNA疗法的发展情况
mRNA疗法市场规模受疫情变化影响,后期将借助产品上市有所回升。
mRNA疗法凭借独特的优势和临床效果,加上新冠疫情阶段的特殊性,2020年-2021年间的市场规模剧增,辉瑞/BioNTech联合开发的新冠疫苗Comirnaty年度销售额连续超过400亿美元。
2021年后,疫情逐渐稳定,针对COVID-19的预防和治疗需求逐渐下降,此时mRNA在其他领域的研究才又被抬上桌来,相关产品逐渐受到市场关注。这段期间,市场规模虽呈下降趋势,但随着mRNA疫苗在肿瘤、流感等其他领域的产品出现,mRNA治疗性药物逐渐补充蛋白质药物、细胞疗法的不足,mRNA疗法的市场规模将迎来新的高潮。
据预测,2035年mRNA市场总体规模将达到230亿美金,其中,预防性疫苗有望达到120-150亿美金,治疗性疫苗预计为70-100亿美金,治疗药物或将达到40-50亿美金。
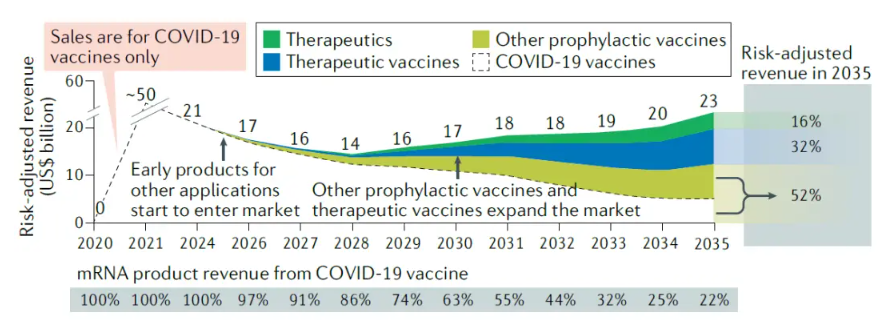
图 1 mRNA技术市场演变预测(中泰证券)
mRNA疗法资本热已过,未来资本市场更关注核心技术能力和管线特点。
新冠疫情期间,mRNA疫苗凭借短研发周期、高治疗效果一战成名,由此mRNA疗法一度成为资本市场的宠儿。2021年mRNA疫苗融资总金额高达61.42亿美元,共发生56起融资事件。
然而这终归是疫情催生下的繁华泡沫,两款明星产品上市后,再无爆款衔接;辉瑞、BioNTech、Moderna之后再无可匹敌的企业;mRNA成药技术也再无关键性突破。当初极高的资本曝光度与后期羸弱的研发能力形成了强烈的预期差,这背后反映出产业链脱节,成药理论不足、技术变现差等问题。
因此2021年后,mRNA疗法相关的投融资动作有所放缓,投资数量和金额都有显著下降。从全球mRNA疫苗融资趋势可以发现投资者虽态度谨慎,但整体仍处于看好的局面。其中尤其关注企业是否掌握mRNA疗法的关键技术如序列修饰、递送载体、工艺优化等,布局管线是否具有先进性和独家性,技术在这过程中变现的可能性有多少。
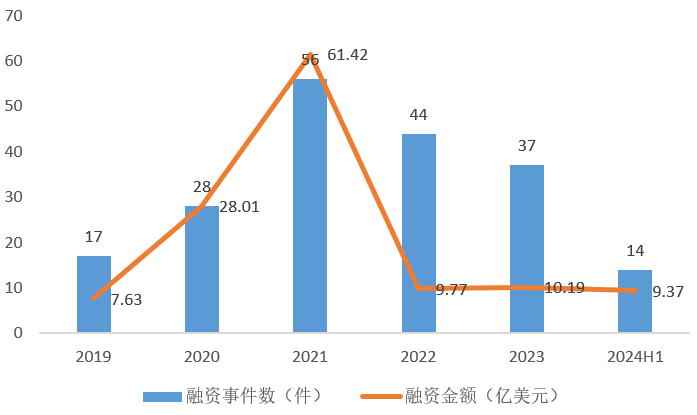
图 2 全球mRNA疫苗融资趋势
国内外研发均以mRNA疫苗为主,适应症多数围绕传染性疾病和肿瘤。
目前全球已获批上市(不包含紧急使用授权)的mRNA产品共三款,均为疫苗,其中两款为新冠疫苗,一款是呼吸道合胞**(RSV)疫苗。最新获批的这款RSV疫苗mRESVIA来自Moderna,用于预防60岁及以上人群出现由RSV引起的下呼吸道疾病。mRESVIA疫苗采用了与Moderna COVID-19疫苗相同的脂质纳米颗粒(LNP)技术。
从临床研究看,截至目前,全球mRNA疫苗产品的数量远超过mRNA治疗性药物,前者约为后者的4倍以上。
从适应症看,mRNA疫苗主要集中于新冠**、RSV、流感**等传染病领域,其他则主要针对黑色素瘤、非小细胞肺癌、乳腺癌等癌症领域。mRNA治疗性药物以治疗癌症为主,其次是各类代谢性疾病、心血管疾病、免疫性疾病等。
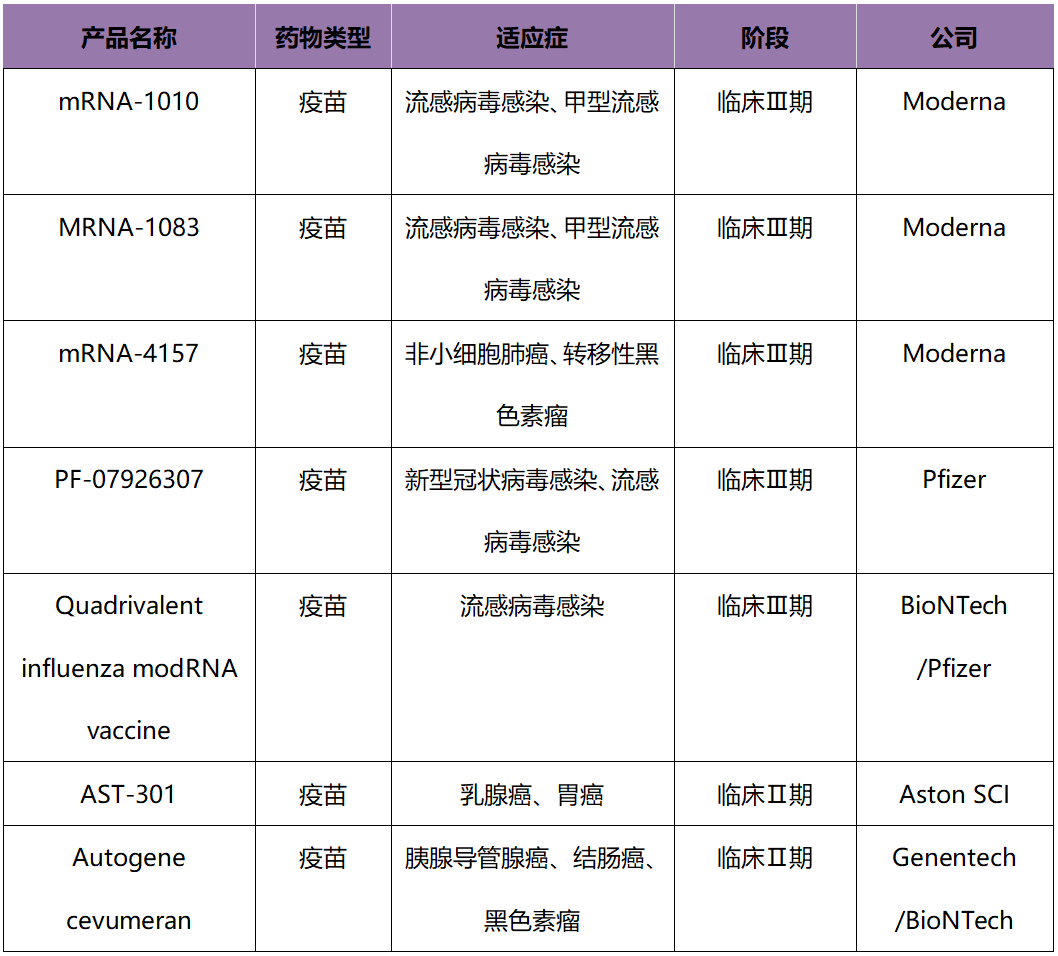
除新冠疫苗外,流感**感染、非小细胞肺癌和黑色素瘤的mRNA药物研发进展最快,均有药物处在临床Ⅲ期。其中,流感疫苗仍以Moderna公司为先头,下设的管线mRNA-1010、mRNA-1083均处于临床Ⅲ期。
同时,治非小细胞肺癌、转移性黑色素瘤的mRNA-4157药物管线也已进入临床Ⅲ期。而针对乳腺癌、胰腺导管腺癌、结肠癌的管线最快处于临床Ⅱ期,由Aston SCI(韩国)和AlphaVax(美国)等公司在研。
表1 全球mRNA药物上市产品表(除紧急使用授权)
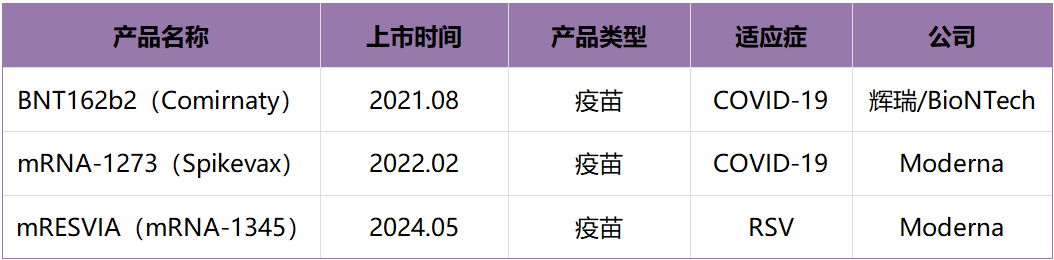
表2 全球研发进展较快的非新冠mRNA药物
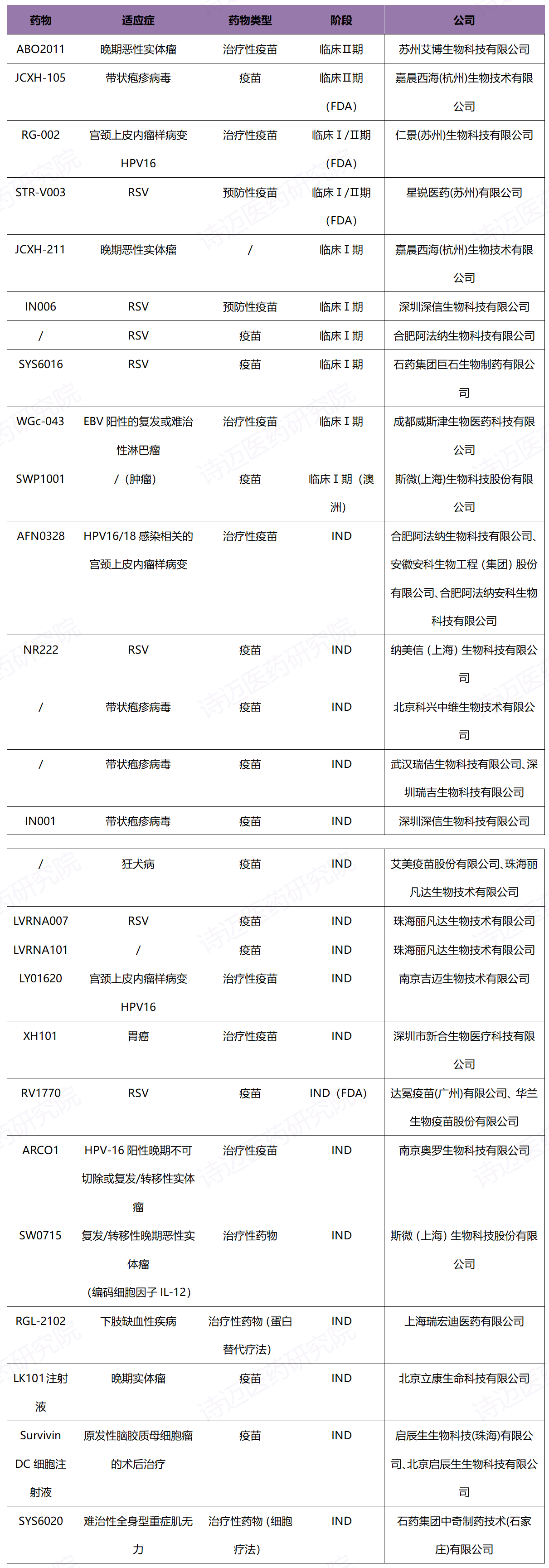
截至目前,国内已获批临床的mRNA药物基本为mRNA疫苗。从研发进度来看,多数处于临床Ⅰ期,随着IND受理数量的逐渐增多,未来临床Ⅰ期仍占比较大。进度最快的是临床Ⅱ期,但数量较少。
从适应症来看,国内临床mRNA药物以RSV、HPV、带状疱疹等传染性疾病为主,尤其是针对RSV感染。其次是肿瘤疫苗包括晚期恶性肿瘤、胃癌、淋巴癌等。从所属公司来看,多数为专攻mRNA等核酸领域或在疫苗领域有丰富研发经验的创新型企业。
表 3 中国mRNA药物临床产品表(除新冠疫苗外)
三、mRNA疗法的技术要点
相比传统疗法,mRNA疗法具备研发周期短,基因风险低,治疗效果好等优势。同时,根据中心法则,mRNA可以表达任意一种蛋白,但在这过程中药物本身的免疫原性、稳定性和胞内翻译效率;生产中的纯化和质量控制都会影响mRNA的最终成药效果。因此,注重序列的设计与修饰、递送载体的选择、生产工艺的优化,既能提高企业自身的竞争力,又能加快产品的高效研发。
相比于小核酸,mRNA的序列要更长,由5’帽结构(cap)、5’非编码区(UTR)、开放阅读框(ORF)、3‘UTR和3’ 多聚腺苷酸(Poly(A))尾这5个原件构成。所以mRNA药物又可以称作长链核苷酸药物。序列长首先带来的就是高免疫原性,加上后期要注射入人体,作为外源物质会通过Toll样受体(TLRs)引起人体产生固有免疫应答,从而产生严重的炎症反应如炎症因子水平升高。
另外,mRNA分子在物理和化学结构上均为不稳定状态。其物理不稳定性包括二级、三级结构的丧失、聚集和沉淀,严重影响mRNA分子的翻译。化学降解对mRNA的稳定性和体内翻译效率影响更大,包括水解和氧化等。已有研究证明,5’cap结构;UTR结构、长度以及调节元件;编码序列的修饰;3’端Poly(A)的设计都会直接影响mRNA的效能。因此,如何通过序列修饰降低mRNA产品的免疫原性,提高其稳定性和胞内翻译效率在药物研发中首当其冲。
常用核苷酸修饰包括m5C、m6A、m7G、肌苷以及2’-O-甲基化等。已有研究发现相对于未修饰的mRNA,上述修饰后碱基的mRNA能使树突状细胞在转导这些mRNA后表现出更少的细胞因子释放以及更弱的免疫炎性反应,从而消除TLR介导的免疫反应。
同时利用上述修饰的碱基替换原始尿嘧啶,不仅显著降低免疫原性,并且极大增加了mRNA翻译效率。如N1-甲基假尿苷修饰的mRNA比假尿苷修饰的mRNA有更多的蛋白质表达和更弱的免疫原性。我们熟识的COVID-19 mRNA疫苗就是采用了N1-甲基假尿苷修饰的mRNA。提高mRNA稳定性策略常通过修饰5’cap结构和3’ Poly(A)尾,以及抗-反向帽类似物ARCA(Anti-Reverse Cap Analog)。
此外,5’UTR和3’UTR所含有的翻译调控元件,通过与RNA结合蛋白的相互作用也可影响到mRNA的稳定性。**自人的α球蛋白和β球蛋白的3’UTR相关元件,常被添加到mRNA中以增加mRNA的稳定性和翻译效率。

图 3 mRNA结构示意图
首先由于mRNA分子量较大且带负电,正常无法通过细胞膜的阴离子脂质双层。其次裸露mRNA在体内易被先天免疫系统的细胞吞噬,并被核酸酶降解。另外,递送载体的组分之间会相互作用从而影响药物整体的稳定性、生物活性等。
因此,选择合适的递送载体实现mRNA在不同靶部位的高效递送是mRNA疗法成功的关键。目前常见的mRNA递送方式有脂质、**样纳米颗粒、高分子聚合物、外泌体、多肽、细胞(如树突状细胞)等。其中LNP是目前临床使用较多且技术较为成熟的方式。LNP是一种两性分子,通常包括可电离脂质、辅助磷脂、胆固醇和聚乙二醇化脂质等组分。
其中可电离脂质与RNA(负电荷)相互结合,辅助磷脂模拟细胞膜脂质双分子层,胆固醇可调节脂质双分子层的流动性,聚乙二醇化脂质可提高纳米颗粒的稳定性。与**载体相比,LNP能够去除感染的风险,致癌风险以及免疫原性风险。其次LNP可通过装饰细胞表面将药物导入到目标位置。
例如在LNP表面增加抗体成分可以实现特异性细胞或者器官的靶向。LNP还能防止mRNA降解,帮助其内吞作用和内吞体逃逸,从而增强抗原表达以及mRNA药物的作用效率。另外,LNP中可添加辅助物,协助免疫激活和潜在的免疫应答。
目前Moderna和辉瑞/BioNTech开发上市的mRNA新冠疫苗都是基于LNP来实现药物递送。临床阶段中较多肿瘤疫苗也是以LNP-mRNA形式存在如Moderna用于治疗皮肤癌的mRNA-4157已进入临床Ⅲ期。
mRNA-载体的制备涉及多个过程,从纯化mRNA原液、到载体制备或筛选、mRNA包封/装载、纯化等,其中mRNA原液纯化和mRNA包封是关键步骤。mRNA 在体外转录(IVT)合成后,产品中可能含有许多杂质包括工艺相关残留如质粒模板、转录反应缓冲液成份、酶、核苷酸和产品相关残留如流产的短链RNA,dsRNA,RNA降解片段等,这些杂质会引起mRNA 的降解,诱导严重的免疫反应,降低翻译性等问题。
基于mRNA产物与反应液中各种残留物质的理化性质差异,比如电荷性、分子量、疏水性等设计纯化方案,以去除目标杂质,得到高纯度的mRNA。目前较为成熟的策略是在IVT反应后添加DNase去除DNA,再进行后续常规的纯化手段如疏水相互作用色谱法(HIC)以有效分离mRNA 与蛋白质、dsRNA 和短 RNA,反相高效液相色谱法(RP-HPLC)以降低dsRNA诱导的免疫反应。mRNA包封即将mRNA 封装进载体中。
这边以LNP举例。LNP具备自组装能力,即脂质成分发生分子间相互作用而自发组织成纳米结构实体。在mRNA-LNP制备过程中,带负电荷的mRNA和带正电荷的可电离/阳离子脂质之间通过静电相互作用结合,再通过脂质组分之间的疏水作用和范德华作用进行组装,进而形成mRNA-LNP复合物。在这过程中,LNP的平均粒径和粒径分布、包封率、制剂中mRNA的完整度、Zeta电位等都是评估制剂质量情况的要点。
目前常用微流控制备mRNA-LNP,与常规方法如薄膜水化法、超声法等相比,微流控条件下LNP合成的均一性、可重复性和放大性上优势明显。基于LNP的自组装特性,微流控制备仪可以将水相和脂质成分快速混合来实现 mRNA-LNP制备。并通过建立相关控制操作条件的关键工艺参数和最佳操作范围,实现对LNP理化特性的精确控制,以确保mRNA-LNP生产的一致性。
四、mRNA疗法的发展方向
1.mRNA肿瘤疫苗
肿瘤免疫疗法旨在激活宿主的抗肿瘤免疫,形成肿瘤抑制微环境,最终实现消除肿瘤以提高患者的整体生存率。而肿瘤疫苗是针对肿瘤相关抗原(TAAs)或肿瘤特异性抗原(TSAs),通过特异性攻击和摧毁抗原高水平表达的恶性肿瘤细胞,并通过免疫记忆实现持续的肿瘤杀伤。
与其他类型的免疫治疗相比,癌症疫苗理论上具备特异、安全和耐受性良好的治疗效果。而mRNA肿瘤疫苗与普通肿瘤疫苗相比,首先拥有较高的安全特性,消除了插入突变的风险;其次mRNA可同时编码多个抗原,具有高疫苗效力;再者,mRNA表达的短暂性质确保了抗原刺激是暂时的,可有效降低慢性炎症或自身免疫反应的可能性。
另外,由于mRNA疫苗具备快速设计和合成能力,根据个体患者的特定肿瘤特征定制疫苗将成为可能。目前,根据编码的物质不同,mRNA肿瘤疫苗的研发方向主要有编码**抗原的mRNA基础癌症疫苗、编码肿瘤抗原的mRNA疫苗和编码免疫调节因子的mRNA疫苗这三类。
适应症主要围绕恶性胶质瘤、胰腺癌、黑色素瘤、非小细胞肺癌等多个高风险、低治愈率的癌种。目前研发进度最快的已进入临床Ⅲ期如Moderna公司治疗完全切除的高风险皮肤黑色素瘤的mRNA-4157,大多数仍处于早期阶段(临床前和临床Ⅰ期)。国内进度最快的已处于临床Ⅱ期如艾博生物治疗晚期恶性实体瘤的ABO2011。未来随着mRNA肿瘤疫苗的频频上市,将补充现有肿瘤疗法的不足,大幅度提升肿瘤患者的治愈率。
2.mRNA体内细胞疗法
细胞疗法作为如今全球新型的免疫疗法,在修复组织、治疗疾病甚至延缓衰老等方面都具备独特优势。
目前国内外已上市多款产品,且临床效果良好。然而该疗法同时也具有较多局限性,如制造过程复杂、对细胞供体的健康状况也有一定要求、高度个体化难以开发通用型现货疗法,以及对实体肿瘤的效果远不如血液癌症等。利用LNP等载体将mRNA递送到患者体内,合成如CAR蛋白并在细胞表面表达,从而将普通T细胞转化为具有特异性抗肿瘤活性的CAR-T细胞的新型方式让研发人员看到了新的可能。
这种方式在临床使用上直接略过体内分离、体外改造的复杂过程,不仅使用方便,在获得与传统个性化细胞疗法的效益的同时还具有更强的通用性。因为mRNA可以设计成为含有多个CAR的形式,用于多个患者,大大降低了生产成本和治疗费用。
此外,由mRNA制备生成的CAR免疫细胞在浸润肿瘤后,不仅能自己杀伤肿瘤细胞,还将招募其它强大的免疫细胞(如NK细胞)进行作用,突破了传统细胞疗法对实体瘤的应用限制。
目前,全球从事相关研究的企业较少,适应症基本围绕在重症肌无力、红斑狼疮等自体免疫疾病,进展最快的是Cartesian公司的Descartes-15,已进入临床Ⅰ期。国内临床进度最快的是石药集团基于mRNA-LNP的CAR-T细胞注射液(SYS6020),近期刚获得CDE临床试验批准。与传统CAR-T产品相比,该产品具有细胞活率高、CAR阳性率高、细胞因子风暴(CRS)等副作用低,以及无基因组整合引起的致瘤风险等优点。在未来,这种创新的体内细胞疗法有望成为一种现货型通用疗法。
3.mRNA蛋白质替代疗法
mRNA是DNA表达成蛋白质的中间产物。因此mRNA疗法除了可以表达抗原来诱导机体的免疫反应外,还可以在体内生成蛋白质,从而替代疾病中的异常蛋白或补充缺失蛋白。
按照上述原理,mRNA可以设计成各类细胞因子、酶等机体所需蛋白质的前体,将其包载在递送载体内,注射给药后在患者细胞内进行翻译,从而应用于肿瘤、罕见遗传病等各类疾病治疗领域,也可用于胶原蛋白补充、骨再生等组织器官修复领域。
目前该疗法尚在早期探索中,研究方向主要集中在遗传性代谢疾病、实体瘤、心血管疾病、皮肤抗衰等。今年9月,Arcturus公司一款针对囊性纤维化的产品ARCT-032已获批进入临床Ⅱ期。该产品是一种吸入型mRNA,旨在让患者肺部直接表达正常的囊性纤维化跨膜导电调节蛋白(CFTR),从而恢复CFTR活动,缓解导致肺部疾病进展的下游效应。
国内,瑞宏迪医药在今年4月临床获批了一款mRNA蛋白替代疗法药物RGL-2102注射液,用于治疗下肢缺血性疾病。其由LNP包载mRNA,给药后可在体内翻译得到目的人源蛋白,促进缺血下肢血管新生,建立侧枝循环,改善缺血区域的血流灌注,从而为传统治疗无效、无法进行手术或血管内治疗的下肢缺血性疾病患者带来新的治疗选择。
另外思珀生物致力于研究细胞外囊泡(EV)装载mRNA蛋白质疗法,已有实验证明使用EV将编码胶原蛋白的mRNA递送到皮肤细胞后,可上调天然胶原蛋白的表达,弥补因衰老/光老化而造成的胶原蛋白流失,大大改善皱纹等衰老症状。目前该疗法正在完善,有望在胶原蛋白流失患者身上实现首个临床应用。
mRNA疗法因其独特的作用原理,先天的治疗优势,在免疫治疗、疾病预防、再生医学等多个领域均有广泛的应用,极具发展前景。但同时该产业发展尚在早期,产业链尚不完善,稳定可控的大规模生产供应链也尚未形成。随着mRNA药物的加速上市,入局者将会逐渐增加,上游原材料供应不足的局面也将有所缓解,超低温储存和运输的要求也将得到满足,更完善的序列修饰、递送方式、生产工艺都将得以升级,从而促进mRNA疗法迈向快速发展的新时代。
— END —