来源 | 诗迈医药研究院(ID:Bio-Smile)
作者 | 白云
编辑 | 符雪宁
2015年8月,***印发的《关于改革药品医疗器械审评审批制度的意见》中指出,我国药品医疗器械存在审评审批效率低下、部分仿制药一致性不佳、药品创新积极性不高等问题,我国药品、医疗器械审评审批制度改革正式拉开序幕;2017年10月8日,****办公厅、***办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,就促进医疗器械产业结构调整和技术创新做出相应部署;2018年,国家药监局正式组建,审评改革不断深化。近2年来,多地省药品监督管理部门相继出台优化医疗器械审评审批政策,加快促进医疗器械产业在区域落地集聚:
2021年12月11日——广西壮族自治区药品监督管理局印发《广西第二类医疗器械优先审评审批程序》
2022年05月11日——广东省药品监督管理局发布了《关于优化第二类医疗器械注册审评审批的若干措施》
2022年10月10日——内蒙古自治区药品监督管理局印发《优化医疗器械审评审批制度促进产业高质量发展工作举措(试行)》
2022年11月01日——陕西省药品监督管理局印发了《陕西省优化境内第二类医疗器械审评审批的若干措施(试行)》
2022年11月09日——四川省药品监督管理局发布《四川省医疗器械快速审评审批办法》
2023年03月14日——浙江省药品监督管理局印发了《关于优化医疗器械注册审评审批的实施意见》
2023年03月23日——重庆市药品监督管理局发布了《重庆市医疗器械优先审批程序》、《重庆市创新医疗器械审批程序》、《重庆市医疗器械应急审批程序》
一、形成统一的医疗器械分类
医疗器械种类繁多,从医用耗材到医疗设备,风险跨度极大。通过对医疗器械分类的不断探索,医疗器械分类管理体系得以日趋完善。
01 制定《风险程度管理分类》
2000年1月4日,***公布了《医疗器械监督管理条例》,其中对于医疗器械按照风险程度实行分类管理:

表 医疗器械风险程度划分
02 制定《医疗器械分类判定》
在《医疗器械监督管理条例》的基础上,2015年国家食品药品监督管理**发布《医疗器械分类规则》,依据有无除人体或重力以外的能量源、是否接触人体、损伤或影响的程度、使用形式等条件,细化医疗器械的具体分类,如下图所示。
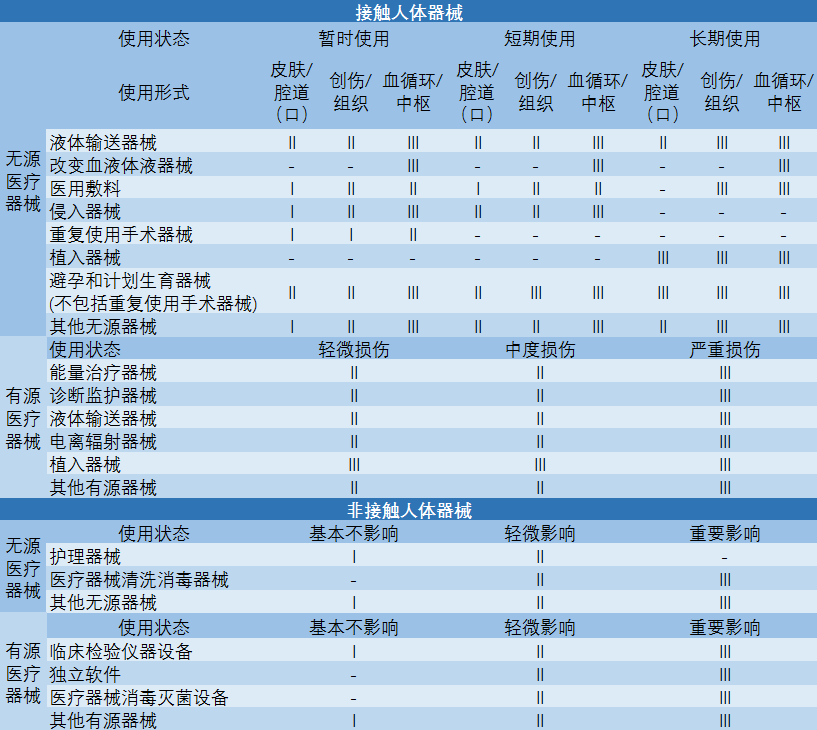
表 医疗器械分类判定表
注:“Ⅰ”、“Ⅱ”、“Ⅲ”分别代表第一类、第二类、第三类医疗器械,-”代表不存在这种情形。因篇幅有限可关注诗迈医药研究院公众号(ID:Bio-Smile)后台回复【B1】获取详细表格。
03 制定《医疗器械分类目录》
在《医疗器械监督管理条例》及《医疗器械分类规则》的基础上,2017年9月4日,国家食品药品监管**发布了新版《医疗器械分类目录》,将医疗器械从原来的43类调整为22个大类,将原结构“产品类别”细分为“一级产品类别”“二级产品类别”两项,并增加了“产品描述”“预期用途”两个项目:
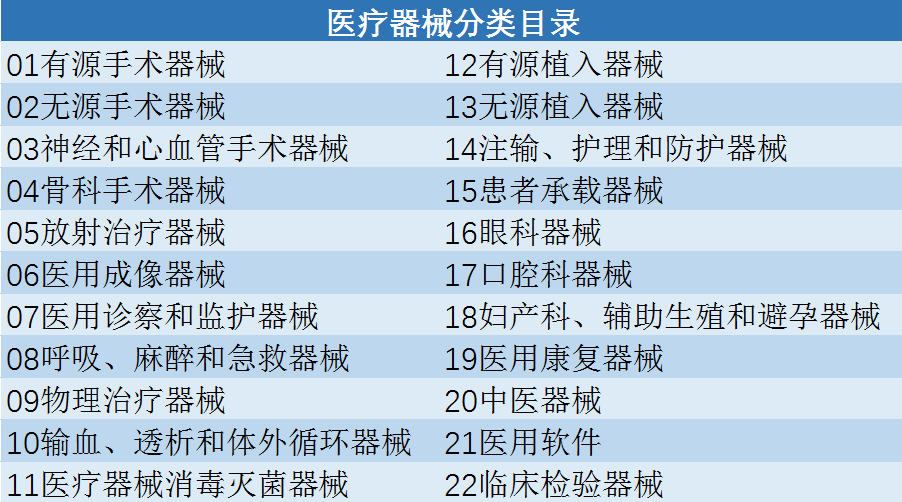
表 医疗器械分类目录
国家药品监督管理局在2020年12月31日对《医疗器械分类目录》中X射线机类等15类进行管理降级,对高频手术器械等产品描述等内容进行了调整;在2022年3月24日对02-15-14夹子装置等10种医疗器械产品涉及《医疗器械分类目录》内容进行调整;在2022年3月30日对扩张器、止血夹等27种医疗器械的产品描述、预期用途、品名举例、管理类别做出调整,并且新增了多项二级类别。通过不定期、动态调整,加强医疗器械管理与创新。
04 推行医疗器械唯一标识(UDI)
医疗器械唯一标识(Unique Device Identifier, UDI)是指采用标准在医疗器械产品或包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别,是医疗器械的身份证,可有效提升医疗器械的科学管理效率。

图表 1 医疗器械唯一标识及示例
国家药品监督管理局经过2020年9月30日、2021年7月19日、2023年2月17日,先后将三批次医疗器械加入UDI实施对象,目前所有第三类医疗器械(含体外诊断试剂)、第二类医疗器械中的109项已成为UDI的实施对象。
二、聚焦四大维度优化注册审评审批
01 医疗器械的注册审评审批流程
对于不同风险程度的医疗器械,我国采取不同的制度。对于第一类医疗器械,实行产品备案管理,第二、第三类医疗器械实行产品注册管理,其中二类医疗器械注册审评由省级药品监督管理部门负责,三类医疗器械由国家药品监督管理局负责;大体流程包括网上申请、提交资料、受理、缴费、技术审评、审核、核准、制证等过程。
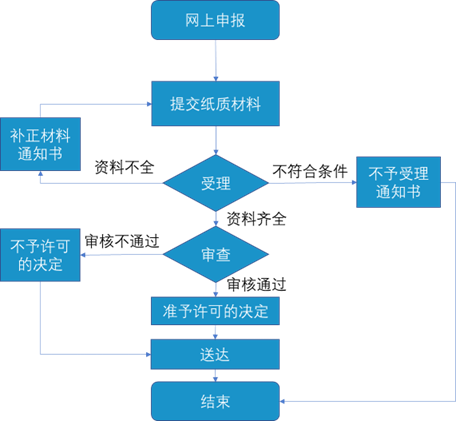
图 二三类医疗器械注册流程
02 优化注册审评审批四大维度
各地医疗器械注册审评审批优化侧重点不尽相同,但总体来说大同小异,以3月14日浙江省药品监督管理局对外发布了《关于优化医疗器械注册审评审批的实施意见》为例,政策主要从以下四大类展开:
1)提升审评审批效能
主要内容包括1.缩短技术审评平均时限。将技术审批平均时限由原来的120个工作日缩短至50个工作日,行政审批时限由20个工作日缩短至5个工作日。2.降低医疗器械注册收费,对相关收费采取七折执行。3.数字化赋能审批。开发上线审评审批信息化智慧系统,数字化手段提升服务效能。
2)优化审评审批流程
主要包括:1.分路径审评。依据项目复杂程度与项目类型调整审评资源与审评模式,提高总体审评效率。2.优化现场检查与审评审批流程。并联同时开展技术审评与行政审批。3.简化已上市产品注册审评审批。建立已上市进口产品与省外迁入产品的快速审评审批机制。
3)加大对优先项目支持
对于被列入国家、省级的重大专项、重点研发项目,突发公共卫生事件应急处理所需器械,创新产品等重点项目及罕见病急需药械等加大力度给予优先支持。
4)提升检验检测效率与服务许可水平
通过开展注册自检相关培训、打造长三角医疗器械检测评价与创新服务综合体,提高审评审批队伍业务水平等,提升服务效能。
03 省局注册审评时限对比
从近2年正式发文的省药品监督管理局看,首次注册审评时限在30-60天不等,其中湖南、山东具有相对优势;行政审批时限在5天或10天。
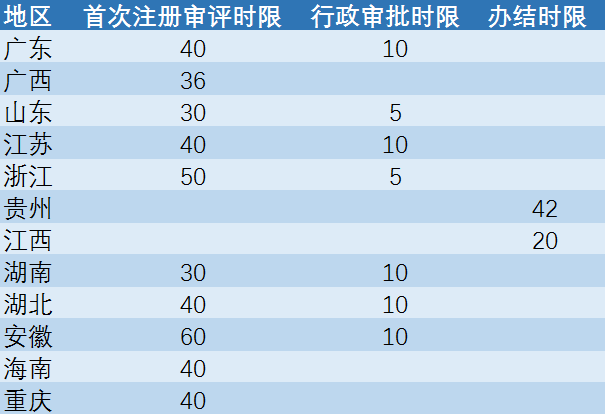
表 目前部分地区二类医疗器械注册办理时限要求
三、三重助推叠加营造产业氛围
01 优化审评审批,助推患者治疗可及性
从医疗器械使用者的角度来看,优化医疗器械注册审评审批流程,加快罕见病、恶性肿瘤、老年特有和多发疾病、临床急需等医疗器械相关产品上市速度,满足特定患者的急切需求,甚至拯救生命。如2023年1月4日、1月17日、2月23日,国家药监局分别应急批准了汉诺医疗、长征医疗、赛腾医疗的ECMO产品,相关国产产品的上市有望将ECMO定价降至百万以下,降低患者经济压力。
02 优化审评审批,助推企业抢占市场
从政策受惠的企业层面来看,优化医疗器械注册审评审批流程,缩短技术审评和行政审批时限,有助于企业加快产品上市节奏,提前抢占市场;同时降低企业审批时间成本,提高企业研发创新意识,激发企业活力。以国内IVD市场巨头迈瑞为例,2022年迈瑞高端凝血平台CX—9000拿证并于6月上市,至年底已取得60台的销量。在当前国产拿证速度不断加快及限制采购进口品牌的背景下,以迈瑞为代表的国产凝血设备不断完成对国外御三家sysmex、stago、werfen市场份额的蚕食,完成国产化替代。
03 优化审评审批,助推区域产业集聚
从政策制定的区域层面来看,优化医疗器械注册审评审批流程,降低区域医疗器械注册上市的门槛,有助于促进区域医疗器械产业集聚,实现区域活力的焕发。如湖南省药监局党组书记秦继红披露,通过深化药品医疗器械审评审批制度改革,2018年底至2022年6月湖南省实现生产企业从375家增至962家,产业规模迅速壮大;二、三类产品注册证数量从1376个增至7203个,增量连续两年全国前列。
关于我们
诗迈医药研究院以“推动医药产业,助力医药梦想”为使命,深耕医药产业13年,依托全国最大的生命健康产业人才数据库( 566 万人)及产业链上下游资源( 7.47 万家),以诗迈产业链一站式服务平台(Biosmile)为内核,提供引才引智、园区运营、产业链招商、产业规划、定制培训、创业孵化、投资融资等服务。
截至目前,诗迈医药研究院为全国106家产业园与企业引进人才 3 万余人,举办行业交流论坛 120 余次,提供 300 余次科研技术、项目规划、管理培训等服务。在上海、北京、武汉、郑州、南京、泰州、苏州、广州、成都、南昌、青岛、深圳均设有分子公司,在欧、美、印设有精英人才和创新项目引进合作点,构建了特色的生物医药产业生态服务链。
- END -
